Development and multi-institutional validation of an artificial intelligence-based diagnostic system for gastric biopsy
by RC4MB
日本病理学会、東京大学原田研究室、NII RCMBの共同研究による、胃生検胃がんの病理診断支援AIに関する論文がCancer Scienceに発表されました。
病理診断では、ある病理医の診断を他の病理医が確認するダブルチェックの仕組みがあります。しかし、日本では全国的に病理医の数は不足しており、2人以上の病理医が常駐する医療機関は限られています。この状況をICTを援用して解決するため、日本病理学会は病理組織デジタル画像 (Pathology-Whole Slide Imaging, P-WSI) のデータベース構築を核とするJapan Pathology Artificial Intelligence Diagnostics Project (JP-AID)を開始し、病理診断精度管理ツールや病理診断支援ツールの開発を行ってきました。今回の研究では、日本人のがんの多く占める胃がんを対象とし、東京大学原田研究室、NII RCMBと連携して胃生検の病理組織診断を支援するAIを開発しました。
https://doi.org/10.1111/cas.15514
Multistage semantic segmentation for pathology
病理医が病理組織標本を検鏡する際、まず拡大率の低い弱拡大で標本の全体を俯瞰し、気になった部分を強拡大で詳細に観察して病理診断を進めます。今回の研究では、この検鏡時の観察原理を機械学習に取り入れ、診断精度の向上を図りました。
P-WSIは画像のサイズが非常に大きく、そのままの解像度で機械学習することはできません。従来法では、P-WSIを一定の小さなサイズの画像 (patch, パッチ) をタイル状に敷き詰めた集合体へ分割し、そのパッチを一つずつ機械学習するアルゴリズム (patch-based AI, PB-AI) が用いられてきました。PB-AIはパッチ個々では一定の判定精度を達成していますが、組織標本全体の病理診断では必ずしも高精度とはいえないアルゴリズムでした。
そこで、パッチから抽出した特徴量の組織標本全体における分布を元にして、P-WSIのセマンティックセグメンテーション (multistage semantic segmentation for pathology, MSP) を実行する新しいアルゴリズムを提案しました。このセグメンテーションが病理組織標本の検鏡における弱拡大観察に相当し、パッチ個々の判定精度を維持したまま組織標本全体の病理診断の精度も高めることに成功しています。
 付図説明 – 従来法のPB-AIでは、炎症性浸潤などが存在するとがん陽性と誤判定するパッチが出現し、組織標本全体でがん陽性と偽陽性判定することがある。提案手法のMSPはパッチの特徴量を元に組織標本をセグメンテーションするため、誤判定パッチの影響を受け難い。
付図説明 – 従来法のPB-AIでは、炎症性浸潤などが存在するとがん陽性と誤判定するパッチが出現し、組織標本全体でがん陽性と偽陽性判定することがある。提案手法のMSPはパッチの特徴量を元に組織標本をセグメンテーションするため、誤判定パッチの影響を受け難い。
多施設で通用する頑健な診断支援AI
組織標本は、フォルマリン固定した組織片をアルコールで脱脂してパラフィンワックスに包埋し、パラフィンワックスごと薄切してスライドガラスに貼り付けて作成します。この薄切切片はほぼ無色で、顕微鏡で観察 (検鏡) する前に細胞や組織を色素で染める必要があります。病理組織標本ではヘマトキシリン・エオジン (Hematoxylin Eosin, HE) 染色が一般的で、ヘマトキシリンで細胞核が青藍色に、エオジンで細胞質やコラーゲンなどの線維が赤色に染まります。このHE染色は処理手順 (protocol, プロトコール) に敏感で、使用する染色試薬の銘柄や染色・洗浄にかける時間、ラボのある地域の水道水の水質などによって染め上がりが異なります。さらに、病理学においてHE染色の統一したプロトコールは存在せず、各医療機関が独自に定めるプロトコールに従っています。つまり、ひとくちにHE染色の病理組織標本と言っても、医療機関ごとに染色の仕上がりが異なることになります。
この医療機関ごとの差違は、病理組織診断を支援するAIにとって診断精度を低める大きな要因です。つまり、ある医療機関のHE染色病理組織標本で機械学習したAIで他の医療機関の組織標本を判定すると、精度が低下する可能性が高くなります。この精度低下は学習結果がそれぞれのパッチの色合いに影響されやすいPB-AIでは顕著となる傾向がある一方、病変領域をセグメンテーションしてP-WSI全体を判定するMSPでは現れ難くなります。実際、今回の研究で10の異なる医療機関に由来するP-WSIで評価すると、PB-AIと比較してMSPは高い精度を維持していました。
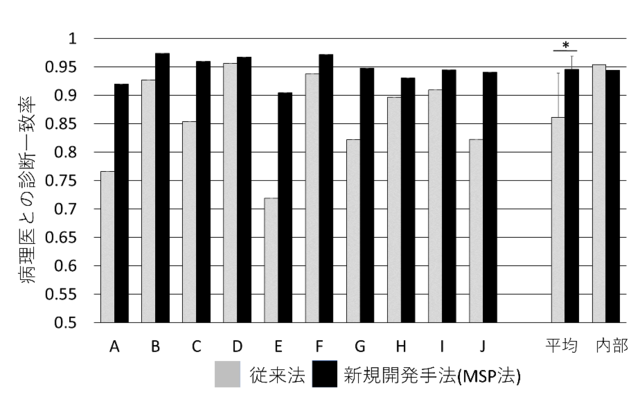 付図説明 – 学習データを提供した医療機関を対照 (内部) として、A~Jの10の異なる医療機関のP-WSIをPB-AIとMSPで判定した。病理医の作成した正解とそれぞれの診断支援AIの判定との一致率を検証したところ、MSPは一貫して高い判定精度を達成した。
付図説明 – 学習データを提供した医療機関を対照 (内部) として、A~Jの10の異なる医療機関のP-WSIをPB-AIとMSPで判定した。病理医の作成した正解とそれぞれの診断支援AIの判定との一致率を検証したところ、MSPは一貫して高い判定精度を達成した。
今後の展開
今回の研究で開発したMSPは病理医に代わって胃生検胃がんの病理組織診断するものではありません。確定診断は病理医のみに許された医療行為であり、機械で代替することはできません。もともと、MSPは病理組織診断のダブルチェックにおいて、病理医の負担を軽減することを目的に開発されました。ダブルチェックを病理医で行うと全ての症例を2人の病理医が検鏡することになります。ここにMSPを導入すると、病理医とMSPの判定が異なる症例のみを2人の病理医によるダブルチェックに供することとなり、病理医の負担を軽減できます。さらに、病理医が1人しかいない医療機関でもダブルチェックにかかる時間的、人的リソースを軽減することが可能でしょう。今後は、MSPをクラウドやサーバで稼働し、ネットワーク経由でダブルチェックを可能とするシステムを構築して社会実装を目指します。
日本病理学会プレスリリース https://www.pathology.or.jp/jp-aid/2022/08/post-20200320.html
国立情報学研究所プレスリリース https://www.nii.ac.jp/news/release/2022/0812.html
Subscribe via RSS
